光不仅为植物光合作用提供能量,还能通过影响植物生长发育更好适应外界环境变化,提升光合作用效率。叶绿素是光合作用不可或缺的组成部分,目前已知光可
以通过调控叶绿素合成酶的基因表达或者酶活性影响植物的叶绿素含量,然而光如何影响叶绿素的合成与降解,调控复杂自然条件下的叶绿素平衡态 (Chlorophyl
l Homeostasis) 的机制目前还并不清楚。
N6甲基化腺苷(m6A)是真核生物中存在最广泛的mRNA修饰,影响着mRNA的剪切、核转运、翻译和降解等RNA代谢过程。2021年,林辰涛课题组在Nature Plants(2021) 发文报道了蓝光诱导的蓝光受体CRY2通过蓝光诱导的液-液相分离招募m6A“编码器 (writer)”MTA复合体进入CRY2的液相中,提高MTA蛋白在CRY2的液相中的浓度而促进m6A修饰,调节m6A修饰的生物钟节律基因mRNA稳定,维持植物生物钟节律。近日,福建农林大学林辰涛教授课题组再次在Nature Plants发表了题为Light-induced LLPS of the CRY2/SPA1/FIO1 complex regulating mRNA methylation and chlorophyll homeostasis in Arabidopsis的研究论文。该研究发现,蓝光诱导CRY2-SPA1-FIO1复合体发生较为缓慢的液-液相分离,直接增强m6A“编码器” FIO1的甲基化转移酶活性,促进叶绿素平衡态调节以及相关基因的m6A修饰和翻译效率,从而影响植物在光下的叶绿素平衡态。同期Nature Plants也刊发了题为Light-induced protein condensation regulates chlorophyll homeostasis的Research Briefing, 详细介绍了该研究的背景和意义。

在对m6A “编码器”突变体的蓝光表型筛选中,作者发现METTL16类型的m6A“编码器”fio1突变体在蓝光下表现出类似蓝光受体cry1cry2突变体的叶绿素缺陷表型,而METTL3类型的mta突变体在同样条件下则表现出正常的叶绿素含量表型。这一结果表明,CRY-FIO1特异的m6A修饰对叶绿素稳态的调控是至关重要的。随后作者对蓝光和黑暗条件下WT,cry1cry2,fio1 和mta材料进行了多组学分析 (RNA转录组,m6A甲基化修饰组,翻译组和蛋白组学) 。分析发现,虽然蓝光通过CRYs调控一部分编码叶绿素代谢酶基因的表达, 但是这些基因并不显示依赖于CRYs和FIO1但独立于MTA的mRNA修饰、翻译与蛋白丰度光调控。与此同时,该多组学分析发现了六个编码叶绿体蛋白的核基因依赖于CRYs和FIO1却独立于MTA的mRNA修饰、翻译与蛋白丰度光调控。之前的研究表明,这六个基因虽不直接参与叶绿素代谢却均具有正调控植物体内叶绿素含量的功能。因此,作者将这六个基因归类命名为CHR (Chlorophyll Homeostasis Regulator), 即叶绿素平衡态调节基因,CRY2-FIO 介导蓝光调控CHR基因的mRNA修饰和翻译对维持蓝光下叶绿素平衡发挥着关键作用。
作者进一步探究了CRY2-FIO1如何特异性调控叶绿素平衡态调节基因的m6A修饰并促进翻译。与CRY2-MTA类似,CRY2和FIO1也存在非蓝光依赖的蛋白互作,但是令人意外的是,在蓝光下FIO1并不能像MTA一样被CRY2直接招募到光小体中,然而在蓝光伴侣蛋白SPA1存在时,FIO1能显著地被招募到液相的光小体中。在体外酶活实验中,作者发现CRY2的CCE结构域和SPA1的WD结构域均能显著提升FIO1的甲基转移酶活性,同时两者也能相互协同增强FIO1的甲基转移酶活性。CRY2的CCE结构域和SPA1的WD结构域是二者与FIO相互作用关键区域,CCE结构域关键互作位点突变后,FIO1不能被招募到CRY2光小体的液相中,同时也不能促进FIO1的甲基转移酶活性。
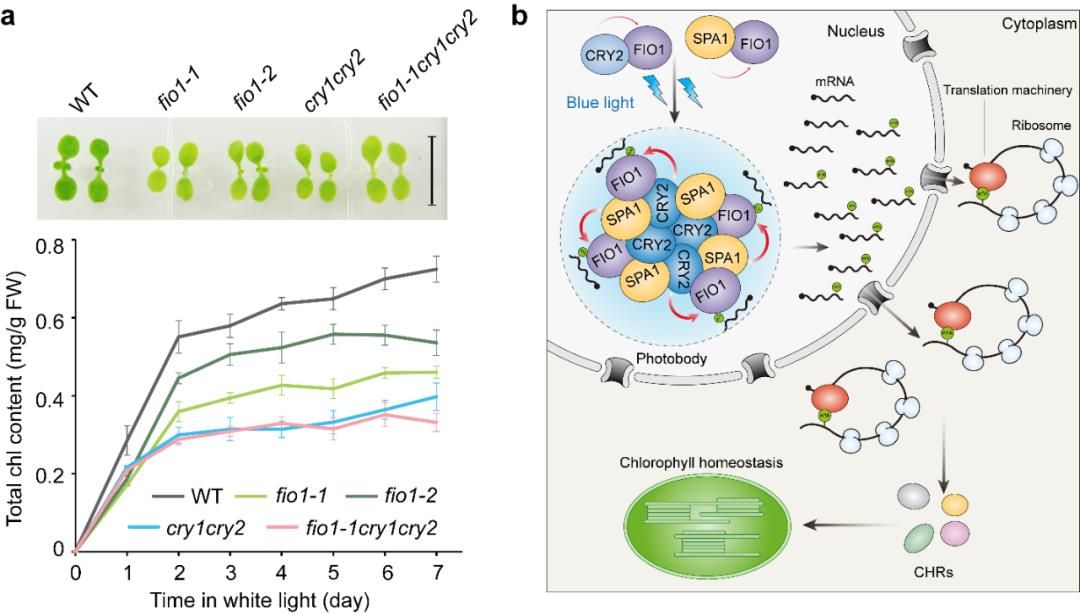
图1. 蓝光诱导的CRY2-SPA1-FIO1液-液相分离调控叶绿素稳态
值得注意的是,该研究论文也是林辰涛教授课题组关于蓝光诱导的液-液相分离调控植物生长发育的第三篇研究论文。此前,林辰涛教授课题组发表了蓝光诱导的CRYs蛋白相分离调控m6A 编码器MTA (Nature Plants, 2021) 和染色质结合蛋白MAC3A/3B活性 (Science Advances, 2023) 影响生物钟节律和下胚轴伸长。这些研究揭示了蓝光诱导的相分离直接调控相互作用蛋白活性,为理解蓝光受体感知及信号转导中的非蓝光依赖相互作用蛋白提供了新的解释。该课题组近期还在Journal of Integrative Plant Biology上对CRY蓝光受体的这一新作用机制进行了综述报道 (doi: 10.1111/jipb.13578) 。
福建农林大学姜博晨博士 (现芝加哥大学博士后), 钟振晖博士 (现加州大学洛杉矶分校博士后) 和顾连峰教授为该论文共同第一作者。福建农林大学海峡联合研究院林学中心林辰涛教授,王旭博士 (现北京大学现代农业研究院王旭研究员) 和姜博晨博士为论文共同通讯作者。芝加哥大学何川教授和加州大学河滨分校Julia Bailey-Serres教授对该研究也做出了重要贡献。该研究得到国家自然科学基金、福建农林大学研究基金、泰山学者青年专家项目、山东省优秀青年科学基金项目(海外) 等项目的支持。
Jiang B., Zhong Z., Gu L., Zhang X., Wei J., Ye C., Lin G., Qu G., Xiang X., Wen W., Gateas M., Bailey-Serres J., Wang Q., Chuan He C., Wang X., and Lin C. (2023). Light-induced LLPS of the CRY2/SPA1/FIO1 complex regulating mRNA methylation and chlorophyll homeostasis in Arabidopsis. Nat. Plants.Jiang, B., Zhong, Z., Su, J., Zhu, T., Yueh, T., Bragasin, J., Bu, V., Zhou, C., Lin, C., and Wang, X. (2023). Co-condensation with photoexcited cryptochromes facilitates MAC3A to positively control hypocotyl growth in Arabidopsis. Sci. Adv. 9, eadh4048. 10.1126/sciadv.adh4048.Wang, X., Jiang, B., Gu, L., Chen, Y., Mora, M., Zhu, M., Noory, E., Wang, Q., and Lin, C. (2021). A photoregulatory mechanism of the circadian clock in Arabidopsis. Nat. Plants 7, 1397-1408. 10.1038/s41477-021-01002-z.https://doi.org/10.1038/s41477-023-01580-0











