Nature Genetics | 福建农林大学/基因组所等单位破译‘铁观音’基因组,揭示茶树群体演化和驯化历史
茶是世界重要的饮料作物,以迷人的香气与多种有益健康的多酚化合物而深受广大消费者的喜爱。然而其滞后的基因组学研究极大限制了利用分子生物学技术进行优良性状的快速选育。随着第一个茶树全基因组的测序完成,围绕茶树的研究如雨后春笋般相继涌出,但乌龙茶系列最具代表性的品种“铁观音”的基因组图谱尚未破译,且茶树的遗传和演化历史仍值得进一步探究。
2021年07月15日,福建农林大学尤民生教授团队联合中国农科院深圳农业基因组研究所张兴坦研究员团队等多家单位在Nature Genetics发表了题为Haplotype-resolved genome assembly provides insights into evolutionary history of the tea plant Camellia sinensis的研究论文。该研究利用自主开发的新算法破译了茶树优良品种“铁观音”的单倍体分型基因组,并在此基础上阐释了等位特异性表达在长期无性繁殖过程中应对”遗传负荷”的机制,以及茶树群体演化和驯化历史,为茶树育种改良提供了新见解。

众所周知,许多重要的作物都是无性繁殖,例如马铃薯、木薯和茶树。无性繁殖可以有效保留亲本优良基因型,快速筛选和培育新品种。然而,这种方式容易造成作物缺乏遗传多样性,更容易遭受病原菌的侵害,并积累大量的有害突变。根据穆勒棘轮效应(Muller's ratchet),有害突变的不断积累会使生物体适应环境的能力大大降低【1】。映射到作物,会直接影响重要农艺性状。因此,解析无性繁殖作物的基因组信息对于及时鉴定和清除有害突变、改善作物品质至关重要。 该研究选取的基因组测序对象‘铁观音’是全国十大名茶之一,也是乌龙茶系列最为出名的品种。其香馥郁持久、味醇厚爽口,闻名中外。茶树因自交
亲和、种间频繁杂交等因素导致了遗传背景复杂,基因组高度杂合且重复序列多,为基因组的解析带来了重重困难。研究人员结合PacBio,Illumina和Hi-C等主流测序技术,利用自主开发的算法(Khaper和ALLHiC)成功获得了”铁观音”两个水平的基因组组装(图1):单倍体基因组和单倍体分型基因组。组装结果显示,单倍体基因组大小3.06 Gb,共含有42,825个蛋白编码基因;单倍体分型基因组大小为5.98 Gb,来自父母本的两套单倍型之间存在大量遗传变异。
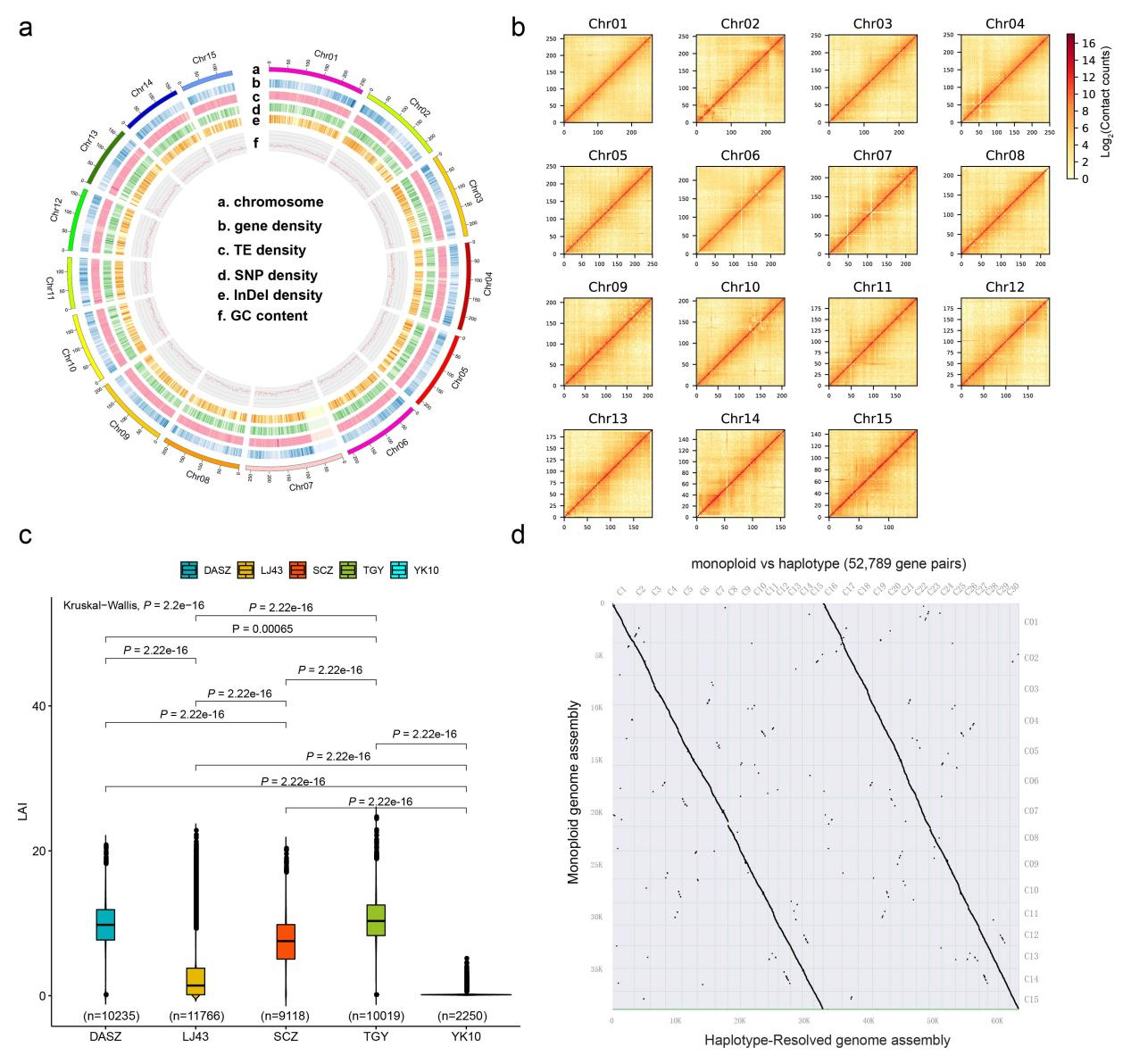
图1. 铁观音基因组组装和质量评估。(a)单倍体参考基因组circos图,呈现15染色体特征;(b)Hi-C热图呈现15条染色体组装质量;(c)LAI评估铁观音基因组和已发表茶树基因组组装质量;(d)铁观音单倍体参考基因组和分型基因组的共线性比较。
铁观音选育于清朝雍正年间,距今已有约300年的栽培历史。长期的无性繁殖积累了大量体细胞突变(包括有害突变),增加了遗传负荷,导致其适应性降低。然而人们对无性繁殖作物如何应对遗传负荷这一问题知之甚少。研究人员基于分型组装获得的单倍体分型基因组,共鉴定出了14,491个基因具有等位变异。绝大多数等位基因保持了较高的序列一致性(93%,图2),选择压力分析显示这些等位基因大都经历了纯化选择(Ka/Ks=0.07)。接着,研究人员利用铁观音不同组织的RNA-seq数据筛选到1,528对等位基因存在一致性的等位特异性表达(consistent Allele-specific expression/ASE),即在所有样本中特定等位基因的表达都高于另一等位基因。基因富集分析显示这些基因参与核糖体、内吞、转录因子和剪接体通路等多个生物学基本过程中,与抵御有害突变机制密切相关。而386对等位基因展现了非一致性的等位特异表达(inconsistent ASE),即两个等位基因分别在不同的组织中存在特异高表达。该类基因主要参与萜烯类及黄酮类挥发物的合成,与植物的适应性演化相关。结果表明,在铁观音基因组中,一致性的ASEG明显多于不一致的ASEG (1,528 vs 386),这一趋势与杂交水稻的结果正好相反,即在杂交水稻中,不一致的ASEG远远大于一致性的ASEG【2】。这种现象或许可以用杂种优势理论中的显性效应解释,长期无性繁殖的茶树利用优势等位基因应答不断积累的遗传负荷,以保持个体的适应度。
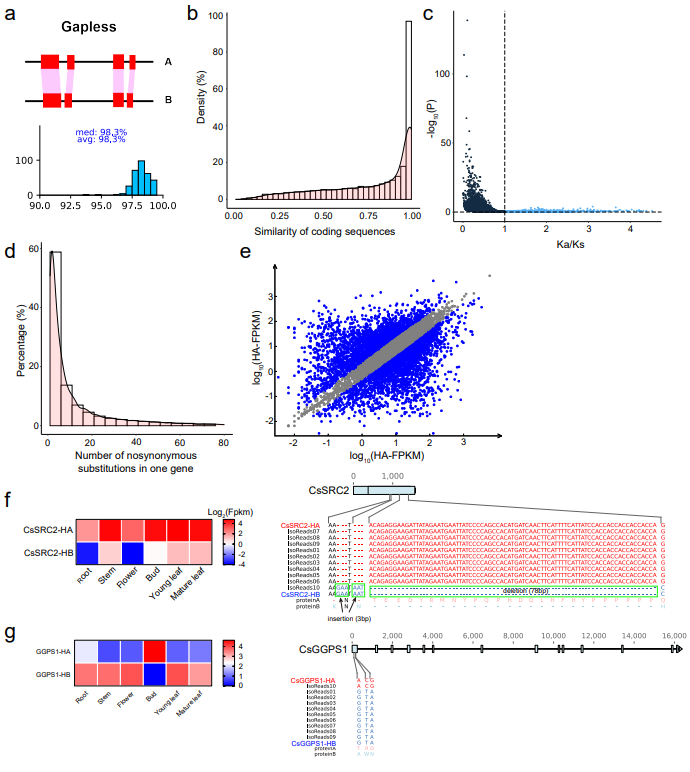
图2. 茶树单倍型基因组的遗传变异及等位不平衡。(a) 两个单倍型序列的比对(10Mb非重叠的窗口);(b)等位基因CDS序列比较;(c)等位基因的选择压力分析;(d)等位基因的非同义替换位点数目分布;(e)等位特异性表达基因(ASEGs)在茶树叶片中的表达情况;(f)举例说明一致性的ASEGs(CsSRC2);(g)举例说明非一致的ASEGs (CsGGPS1)。
通过对176份(15份大理茶和161份茶树)种质资源重测序数据分析,研究人员发现这些个体可以分为三个大组(图3),分别为大理茶(CT),大叶茶(CSA)和小叶茶(CSS),与茶树的形态学分类一致。另外大叶茶(CSA)可以分类古大叶茶(ACSA)和栽培大叶茶(CCSA);而小叶茶(CSS)依据地理分布可分为四个亚组,分别为SSJ(陕西,四川,江西),ZJNFJ(浙江和福建北部),SFJ(福建南部),HHA(湖北,湖南和安徽)。祖先血缘分析显示不同地域的茶树存在频繁的遗传交换,同时发现了一些历史杂交事件与现代育种进程吻合。同时大叶茶遗传多态性高于小叶茶,与前人的研究结论相符。茶树的遗传多样性可能与其频繁的种间和种内杂交有关。研究人员对20个茶组植物(12个近缘种和8个茶树品种)的系统发育分析显示频繁的基因流在茶树及茶树近缘种之间广泛存在。
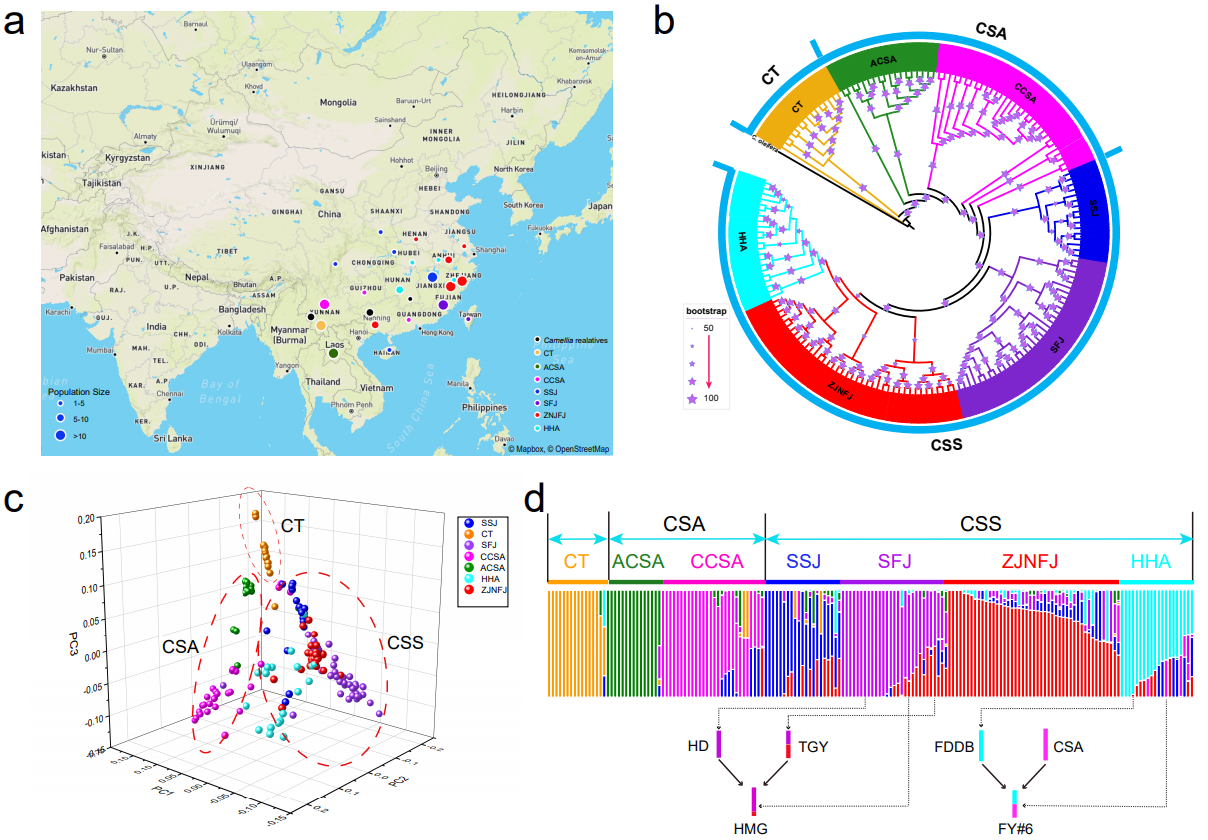
图3. 茶树群体系统进化与群体结构分析。(a)重测序样本的地理分布;(b)群体系统发育树;(c)PCA主成分分析;(d)群体遗传结构分析(k=7)。
茶树种群历史动态变化分析显示CSA和CSS在距今约2.59-1.81个百万年前(格拉斯期)共同经历了一次瓶颈事件,与同期的环境因子相吻合(图4)。此外,在CSS群体中发现了第二次瓶颈事件(大约处于末次盛冰期的极低温时期(2.65-1.90万年前)。在此之后,其种群规模迅速扩张,而CSA群体中未检测此类事件。表明大叶种茶和小叶种茶在分化之后具有不同的演化历史。
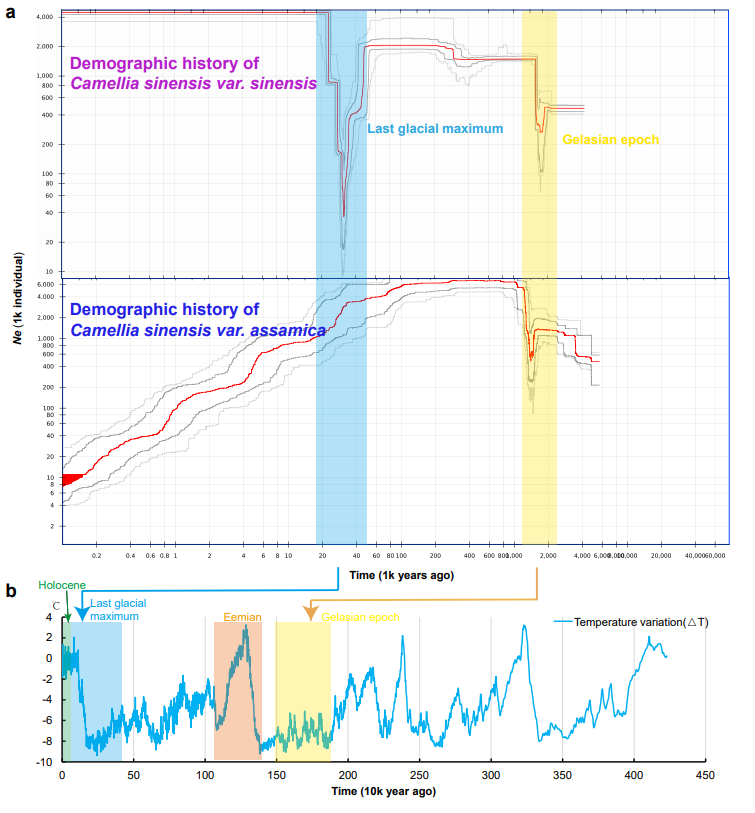
图4. 大叶茶和小叶茶的种群历史动态。(a)大叶茶和小叶茶群体规模(Ne)变化;(b)同时期全球的气温变化。
大叶茶和小叶茶性状差异显著,比如芳香化合物的含量、株高和耐寒性等,这些重要的经济性状很可能是人工驯化的目标(图5)。研究人员发现,大叶茶和小叶茶经历了独立的驯化历程,且在不同的历史时期人们的选育目标也有所差异。在早期驯化阶段,大叶茶受选择基因主要参与了糖苷转运等通路;而在品种改良过程中,与生物碱和香气代谢的基因则更多的受到了选择。例如,CsXDH基因在品种改良阶段受到人工选择,该基因编码黄嘌呤脱氢酶,是参与咖啡因合成的关键基因【3】。在早期阶段,小叶茶受选择的基因主要与植物防御相关;同时,这些受选择基因还参与了部分次级代谢物的合成。例如,儿茶素合成通路的关键基因F3’H也在这一阶段受到了强烈的人工选择。在小叶茶的改良驯化过程中,研究人员鉴定到一些与花发育相关和一氧化氮(NO)响应的基因。先前的研究表明,NO通过加速γ-氨基丁酸的消耗来提高茶树的耐寒性【4】,表明小叶茶的耐寒性状也很可能经历了人工驯化。
茶树矮化对提高茶叶产量意义重大。研究人员鉴定到两个细胞色素P450家族基因(CsDWF4和CsBAS1)分别在大叶茶和小叶茶中受到人工选择。这两个基因是油菜素内酯的生物合成的关键基因,参与植物的光形态建成相关。前人研究表明,BAS1的双突变体在拟南芥中导致下胚轴伸长且光敏感度下降,而DWF4基因的突变则导致了其侏儒的表型【5,6】。该研究表明,茶树的株高在长期栽培过程中也受到了人工选择,而CsDWF4和CsBAS1基因极有可能为植株矮化、产量提高这一茶产业界的“绿色革命”做出贡献。
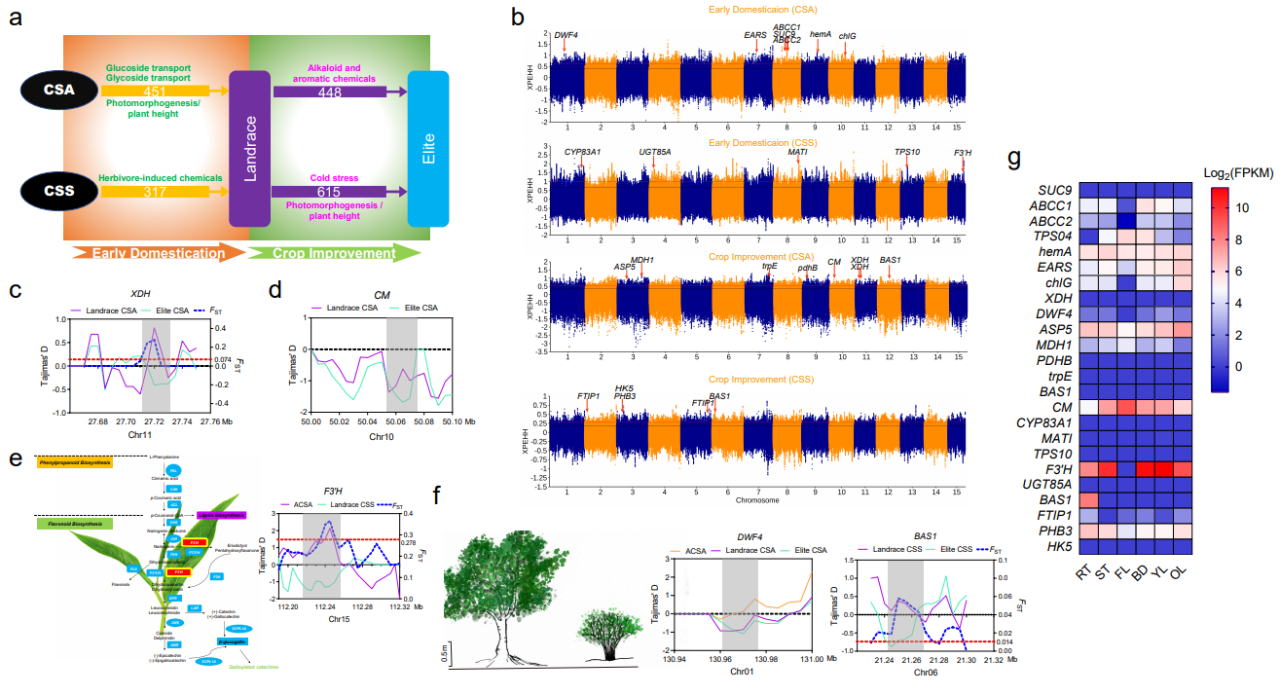
图5.大叶茶和小叶茶的平行驯化。(a)平行驯化模式图;(b)全基因组的选择性清除信号;(c-f)重要基因的人工选择信号(XDH, CM, F3’H, BAS1, DWF4);(g)人工选择基因的表达情况。
该研究由福建农林大学、深圳基因组所等多家单位合作完成。深圳基因组所张兴坦研究员、福建农林大学硕士研究生陈帅、福建省农科院水稻所施龙清博士、中国农科院烟草研究所龚达平副研究员为论文共同第一作者,福建农林大学尤民生教授、唐海宝教授和深圳基因组所张兴坦研究员为共同通讯作者。参与该项目的人员还包括福建农林大学叶乃兴、王海峰教授,赵茜、马晓开博士,研究生张晟铖、廖振阳、王鹏杰、石岩、王毅斌、余嘉鑫、徐鑫丹、齐睿、王文玲、马昀然、马东娜、林京、魏柳锋、马亚影、李若愚、何海芳,杭州开泰生物技术公司詹东亮,加拿大布洛克大学Liette Vasseur教授,福建省农科院茶叶研究所孔祥瑞、江西省农科院桑茶研究所胡桂萍博士,中南林业科技大学张琳教授,美国伊利诺伊大学香槟校区Ray Ming教授,中科院西双版纳热带植物园王刚研究员。
参考文献
[1]J-Muller H. Some Genetic Aspects of Sex[J]. The American Naturalist, 1932, 66(703).
[2]L Shao, Xing F, Xu C, et al. Patterns of genome-wide allele-specific expression in hybrid rice and the implications on the genetic basis of heterosis[J]. Proc Natl Acad Sci U S A, 2019, 116(12): 5653-5658.
[3]K-M Herrmann, Weaver L-M. THE SHIKIMATE PATHWAY[J]. Annu Rev Plant Physiol Plant Mol Biol, 1999, 50473-503.
[4]Y Wang, Xiong F, Nong S, et al. Effects of nitric oxide on the GABA, polyamines, and proline in tea (Camellia sinensis) roots under cold stress[J]. Sci Rep, 2020, 10(1): 12240.
[5]S Choe, Dilkes B-P, Fujioka S, et al. The DWF4 gene of Arabidopsis encodes a cytochrome P450 that mediates multiple 22alpha-hydroxylation steps in brassinosteroid biosynthesis[J]. Plant Cell, 1998, 10(2): 231-243.
[6]E-M Turk, Fujioka S, Seto H, et al. BAS1 and SOB7 act redundantly to modulate Arabidopsis photomorphogenesis via unique brassinosteroid inactivation mechanisms[J]. Plant J, 2005, 42(1): 23-34.
论文链接:
https://doi.org/10.1038/s41588-021-00895-y